近日,金沙集团1862cc生命科学与技术学院罗振革课题组在国际期刊Cell Reports(《细胞报告》)在线发表题为“A hominoid-specific signaling axis regulating the tempo of synaptic maturation”的研究论文:利用体内外多种研究体系,揭示了促进人类神经元形态复杂化及控制突触发育进程的复杂分子细胞机制。

在进化的过程中,人类脑容量显著扩增,大脑皮层表面积的扩张促使沟回形成及复杂化。与其他哺乳动物及灵长类动物相比,人类大脑皮层神经元的树突分支更为复杂,且具有更大密度的突触。这些特征导致人类神经元具有更强的信息处理能力,被认为与人类智力的演化密切相关。近年来,罗振革实验室对该重大问题展开系统深入的研究,发现了人科特异基因TBC1D3促进灵长类特征性神经祖细胞的产生与增殖,导致大脑皮层的扩增及沟回形成。
相较于其他物种的神经元,人类神经元的成熟需要更长的时间,突触可塑性关键期大大延长,这一现象被称为幼态持续(neoteny),该特征可能与人类学习和认知能力的进化密切相关。针对“人类神经元如何获得如此复杂的形态特征以及维持延长的成熟时程”这一问题,罗振革团队研究发现,作为人类基因组中的核心重复单元,TBC1D3基因促进人类神经元的树突分支并维持突触发生过程的幼态持续。本工作建立了人类多能干细胞向大脑皮层神经元诱导分化体系,发现敲除TBC1D3基因导致树突分支减少和兴奋性突触结构树突棘的早熟。在小鼠大脑皮层中过表达TBC1D3会增加神经元树突分支并延长树突棘的成熟时间。进一步发现由TBC1D3维持的幼稚态树突棘具有高水平的突触可塑性和活跃的结构动态。
在机制方面,TBC1D3与肌动蛋白单氧化酶MICAL1相互作用,并激活MICAL1的肌动蛋白(F-actin)剪切活性,TBC1D3-MICAL1复合物分为两个不同的信号通路调节神经元发育。在人类神经元发育的早期阶段,TBC1D3-MICAL1主要定位在细胞质中,通过解聚F-actin来促进树突的复杂化。在神经元发育后期突触形成阶段,TBC1D3-MICAL1定位到细胞核中,结合染色质重构蛋白ATRX,弱化后者与基因组的相互作用,减慢突触形成相关蛋白的表达,延长突触成熟进程。由此,该研究揭示了人类进化过程中神经元发育与成熟的分子细胞机制,对于理解相关神经系统疾病机理、干预神经元衰老进程也提供了新启示。
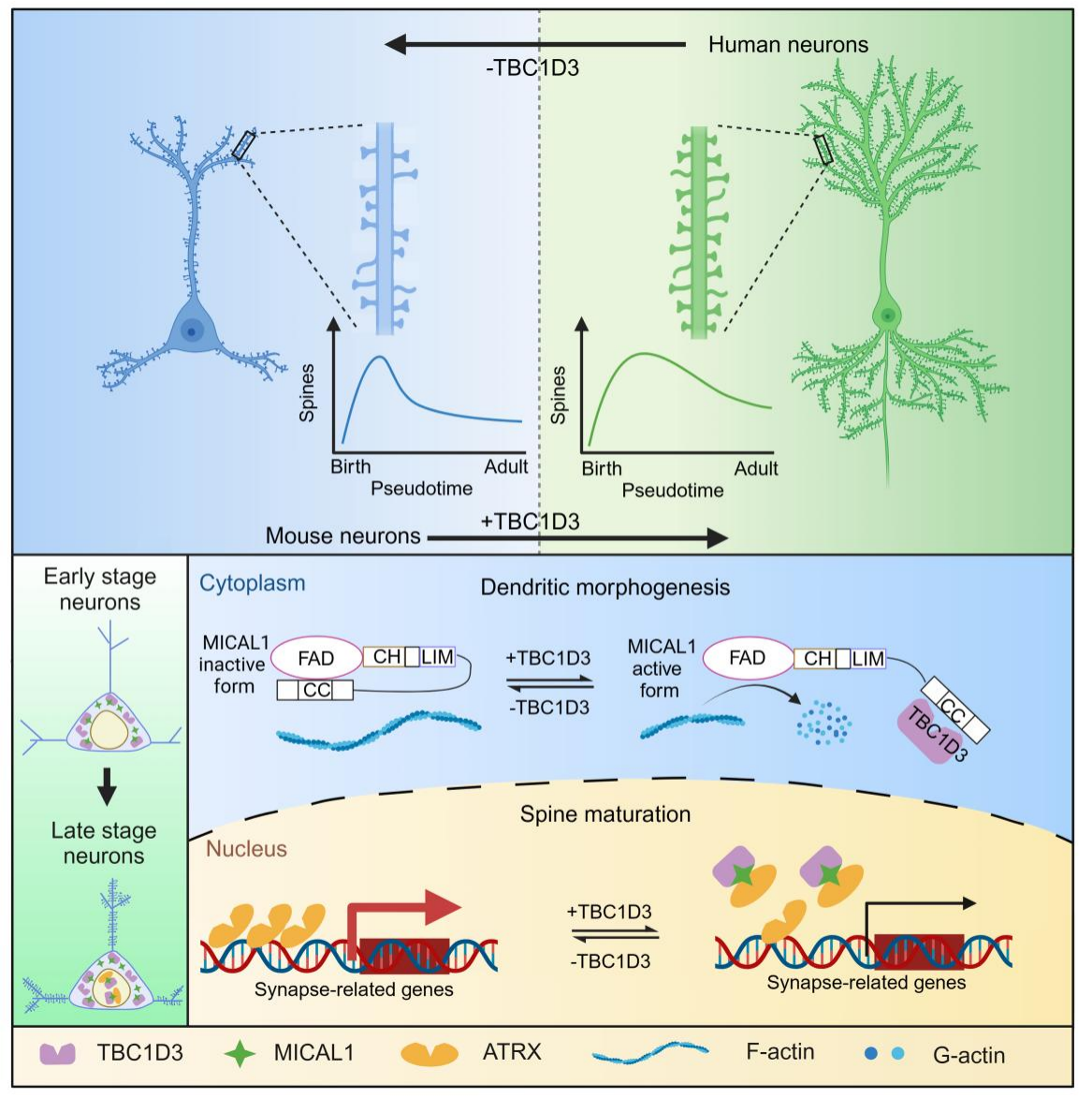
图注:TBC1D3调节人类神经元发育以及分子机制
金沙集团1862cc生命科学与技术学院罗振革组博士后董健及胡霁组副研究员朱晓娜为该文共同第一作者,罗振革教授为通讯作者,金沙集团1862cc为唯一完成单位。该项研究得到生命学院胡霁和杨扬课题组的技术支持。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号