结核病是由结核分枝杆菌引发的传染性疾病,主要侵袭肺部,严重时可导致死亡,是全球关注的重大公共卫生问题之一。贝达喹啉(Bedaquiline, BDQ)是一种靶向结核分枝杆菌ATP合成酶的抑制剂,可高效抑制结核分枝杆菌的生长,是近半个世纪以来第一个上市的抗结核新药,更被世界卫生组织列为耐利福平结核病和耐多药结核病长程治疗方案的首选药物。
然而研究发现,BDQ由于与钾离子通道蛋白hERG相互作用导致患者心脏发生心律失常的风险增加,且对人源ATP合成酶也存在潜在的交叉抑制活性。因此,揭示结核分枝杆菌ATP合成酶的工作机制和BDQ的作用机理及其抑制人源ATP合成酶活性的分子机制,将有效助力新型结核分枝杆菌ATP合成酶抑制剂的开发。

7月3日,金沙集团1862cc免疫化学研究所特聘教授饶子和院士、高岩副研究员联合南开大学生命科学学院贡红日教授、广州国家实验室刘凤江副研究员在《自然》(Nature)发表了题为“Inhibition of M. tuberculosis and human ATP synthase by BDQ and TBAJ-587”的研究论文,阐释了贝达喹啉及其衍生物TBAJ-587抑制结核分枝杆菌ATP合成酶的分子机理,揭示了它们与人源ATP合成酶间的交叉反应机制,对于开发新一代高选择性的抗结核药物具重要指导意义。
研究利用“基因敲入-基因敲除-基因过表达”策略,结合亲和层析及凝胶过滤层析蛋白纯化方法,最终借助耻垢分枝杆菌获得了均一稳定有活性的结核分枝杆菌ATP合成酶蛋白样品。而后借助单颗粒冷冻电镜技术,成功解析了BDQ结合状态下的结核分枝杆菌ATP合成酶的高分辨率冷冻电镜结构(如图1所示)。本研究发现,BDQ主要通过喹啉基团(A基团)和二甲氨基基团(D基团)与结核分枝杆菌ATP合成酶强烈地相互作用并结合到跨膜区域的多个位点,阻止了ATP合成酶跨膜区域c环的旋转,进而阻断了质子的运输,最终阻止了ATP的合成,达到“饿死”结核分枝杆菌的目的。
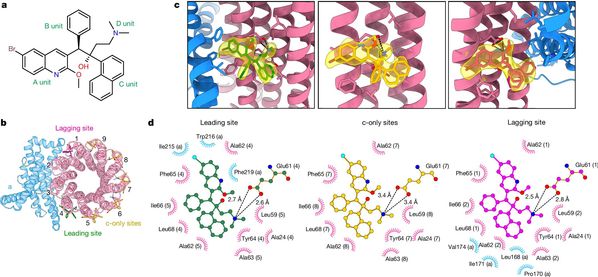
图1 结核分枝杆菌ATP合成酶结合BDQ的冷冻电镜结构
BDQ衍生物中最具代表性的是TBAJ-587和TBAJ-876,目前候选药物均已进入临床试验。TBAJ-587结合状态下的结核分枝杆菌ATP合成酶高分辨率冷冻电镜结构的解析结果(图2)显示,TBAJ-587与结核分枝杆菌ATP合成酶的结合模式和BDQ的结合模式相同,且TBAJ-587与BDQ均主要通过A基团和D基团与结核分枝杆菌ATP合成酶发生相互作用。
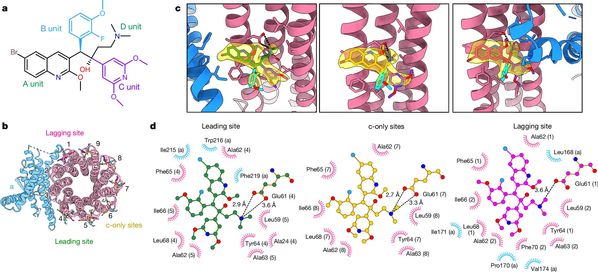
图2 结核分枝杆菌ATP合成酶结合TBAJ-587的冷冻电镜结构
研究还分析发现了BDQ和TBAJ-587均对人源ATP合成酶存在交叉反应。人源ATP合成酶结合BDQ的冷冻电镜结构(图3)解析结果显示,基于BDQ中B基团和C基团再设计产生的TBAJ-587只是降低了与hERG蛋白相互作用引发心律失常的风险,A基团再设计优化才有可能降低与人源ATP合成酶的相互作用,规避临床治疗中带来的潜在健康风险。
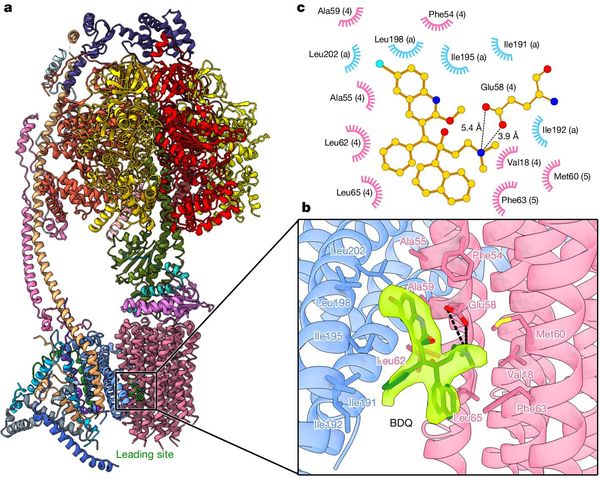
图3 人源ATP合成酶结合BDQ的冷冻电镜结构
南开大学生命科学学院贡红日教授、金沙集团1862cc免疫化学研究所特聘教授饶子和院士、广州实验室刘凤江副研究员、金沙集团1862cc免疫化学研究所高岩副研究员为本文共同通讯作者。
原文链接:
https://www.nature.com/articles/s41586-024-07605-8


 沪公网安备 31011502006855号
沪公网安备 31011502006855号