5月20日,金沙集团1862cc生命科学与技术学院盖景鹏课题组与中国科学院上海有机化学研究所生物与化学交叉研究中心于杰课题组、加拿大蒙特利尔大学Alexey V. Pshezhetsky课题组在《自然结构与分子生物学》(Nature Structural & Molecular Biology)发表了题为“Structure and mechanism of lysosome transmembrane acetylation by HGSNAT”的研究论文,解析了HGSNAT无底物结合apo状态、与乙酰辅酶A(Ac-CoA)结合以及与乙酰化产物结合的冷冻电镜结构,揭示了一种由乙酰肝素-α-氨基葡萄糖N-乙酰转移酶(HGSNAT)介导、不同于传统的乙酰转移酶的全新溶酶体跨膜乙酰化分子机制,为开发更有效的治疗粘多糖症ⅢC(MPS IIIC)疾病的治疗策略提供了结构线索。
硫酸乙酰肝素(HS)是位于细胞表面和细胞外基质中最常见和最重要的糖胺聚糖之一,在发育、炎症、血管生成、细胞生长和病毒感染等一系列生物过程中发挥重要作用。HS的降解需要多种溶酶体酶的协同,其中HGSNAT是过程中唯一的非水解酶和溶酶体跨膜蛋白酶,催化HS末端氨基葡萄糖的跨膜乙酰化以促进进一步裂解。
HGSNAT功能障碍会引发HS在多个细胞和组织的溶酶体中积累,最终导致神经性溶酶体贮积病(LSD)——MPS IIIC,表现为神经功能恶化、多动、睡眠障碍、听力丧失和儿童痴呆。目前该疾病没有有效治疗方法,因此阐明HGSNAT的结构对于开发药物伴侣以及靶向HGSNAT治疗MPS ⅢC至关重要。
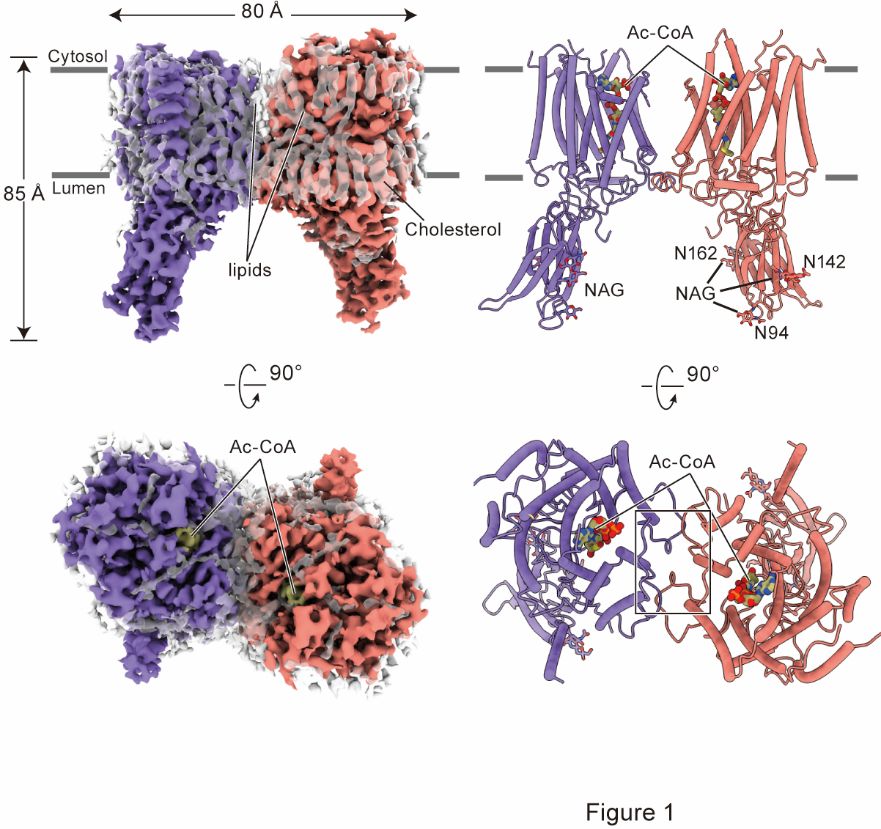
图1. HGSNAT的整体结构
本工作解析了以二聚化的形式存在的HGSNAT,其整体形状类似于大写字母“M”,是一种全新的折叠结构(图1)。HGSNAT的跨膜螺旋形成亲水性的跨膜通道。位于胞质侧的Ac-CoA进入跨膜通道并引起通道扩张。通道中的活化位点组氨酸和天冬酰胺催化乙酰基从Ac-CoA转移到位于溶酶体侧的HS的葡萄糖胺基,完成乙酰基从细胞质一侧转移到溶酶体侧。反应后,游离CoA被释放到细胞质中,乙酰化HS扩散到溶酶体腔内,进一步被降解(图2)。
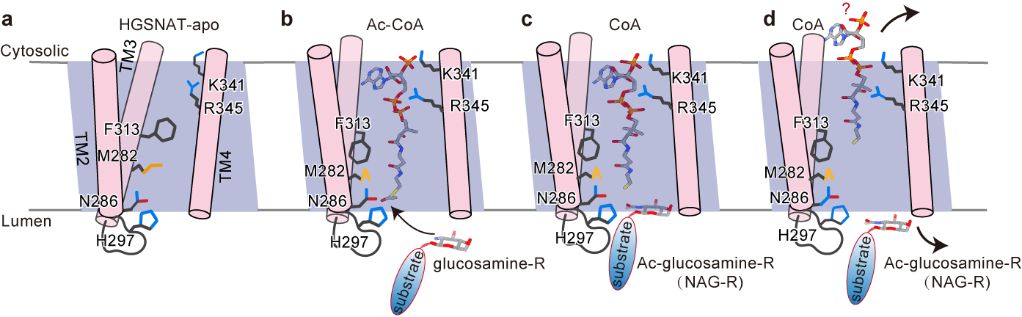
图2. HGSNAT的跨膜催化模型
中国科学院生物与化学交叉研究中心博士研究生徐睿声、金沙集团1862cc硕士研究生宁莹洁为本文共同第一作者。于杰、盖景鹏与Alexey V. Pshezhetsky为本文共同通讯作者。有机所交叉中心朱正江研究员以及本文其他作者也做出了重要贡献。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号